2022. 6. 3. 17:34ㆍ재미있는 생물학/재미있는 생물학
연구를 하면서 떼놓을 수 없는 Histopathology에서의 현미경 imaging, tissue sectioning 등에 대한 공부 글입니다 :) 💬💬

우리가 조직학적으로 무언가를 보기 위해서 현미경을 사용하곤 하는데요,
현미경에 sample을 올려놓기 까지의 과정이 생각만큼 단순하지는 않습니다.
오늘은 tissue sample을 어떻게 얻고,
어떠한 과정을 거쳐 염색시키며,
현미경으로 관찰하기까지의 어떤 과정이 숨어있는지에 대해서 알아보겠습니다.
1. Preparation of Histologic Section
현미경을 통해서 관찰할 수 있는 조직학적 절편은
일반적으로 0.5~10 micrometer(μm)
이상의 두께로 다양한 조직의 얇은 조각입니다.
이러한 절편을 준비할 때,
1) 조직 조각을 supporting medium(지지체)로 침투시키거나
2) 동결(frozen)시킨 다음
microtome이라고 하는 절단 도구로 절단하게 됩니다.
Sample을 자르는 방식에는 여러가지가 존재하지만
오늘은 조직 실험에서 가장 루틴하게 사용되는 방식인
paraffin section
에 대해서 설명겠습니다.
▶ Paraffin Section
paraffin section이란,
조직검사를 위해 tissue에서 sample을 얻어낸 뒤,
fixation 과정을 거쳐 현미경을 통해 관찰하는 방식입니다.
그 과정은 다음과 같은데요!
▷ Paraffin section 순서

1. Removing organ samples from an animal
2. Cutting a tissue or organ into pieces
sample을 적절히 작게 잘라야 우리가 실험할 때 control이 쉽고,
조직 손상을 최소화할 수 있습니다.


3. Fix
그리고 이러한 tissue sample을
buffered (완충된) 포르말린(formalin)
이나
Bouis's
와 같은 고정액에 넣습니다.
여기서 고정액은 이론적으로는 sample의 정상적인 형태를 보존하고,
후속 처리를 용이하게 해주는 역할입니다.
4. Dehydration by ethanol series
fixation 과정이 끝나서 sample 고정이 되었다면
70% alcohols to 100% alcohols
까지 alcohol(알코올) 농도를 증가시켜가면서 시료를 탈수시킵니다.
서서히 알코올 농도를 증가시키는 이유는,
탈수 과정이 너무 급격히 일어나 조직의 손상이 발생하는 것을 방지하기 위함이며,
탈수 과정을 거치는 이유는 bacteria infection 등을 방지하기 위해서 입니다.
5. Clearing by xylene or toluene
다음 과정으로 100% alcohol(알코올) 및 paraffin(파라핀)과 섞일 수 있는
zylene(자일렌) 등의 물질에 sample을 넣게 됩니다.
(이렇게 zylene이나 toluene은 sample의 lipid를 제거해주는 역할입니다.)
alcohol과 paraffin이 서로 섞이지 않기 때문에
dehydrated tissue에 paraffin을 침투시키기 전에
이 중간 단계는 필수적입니다.
그리고 infiltration(침투) 동안에 녹은 paraffin이 xylene을 완전히 대체하게 됩니다.
6. Embedding
infiltration 과정이 다 끝나면, sample을 fresh, melted paraffin으로 embedding된 mold로 옮기고 경화시킵니다.
7. Section with microtome
이후 경화된 paraffin block(파라핀 블록)은 microtome(마이크로톰)에 고정되고,
연속 sectioning되어 실험에 사용하기 적절한 두께의 샘플을 얻어내게 됩니다.
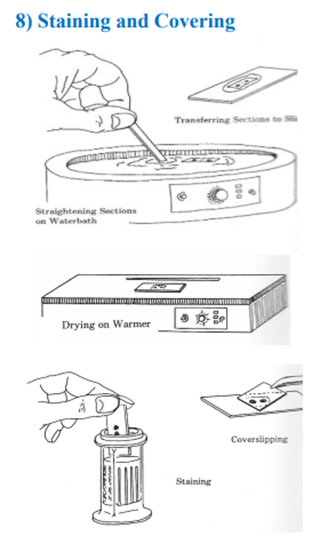
8. Staining and Covering
microtome에 의해서 잘린 section을 손상되지 않게
조심스레 분리하고,
물 표면으로 옮깁니다.
이후 paraffin 단면이 접히거나 주름지지 않도록
평평하게 펴준 뒤 warmer에서 건조시켜줍니다.
sample이 건조되면서 slide에 부착되게 되는데요,
staining 과정에 들어가기 전에
우리는 먼저 paraffin을 제거해주어야 합니다.
xylene(자일렌)이나 toluene(톨루엔)을 사용해
paraffin(파라핀)을 제거한 뒤,
sample을 redehydration(재탈수) 시키고 staining을 하셔야 합니다 :D
이후에 다시 100% alcohol to 70% alcohol로 xylene/toluene를 제거하셔야 하고,
water washing을 통해서 남아있는 alcohol도 제거하셔야 겠죠?.?
이 모든 과정이 끝나야 staining 과정으로 넘어가실 수 있습니다!
결과적으로 우리는
Paraffin-based embedding media로
infiltrated(침윤된) tissue(조직)에서
2~3μm 두께의 우수한 sample을 만들어낼 수 있습니다.
section은 현미경 slide glass에 부착되고,
다양한 세포 및 세포 간 구성 요소의 가시성을 높이기 위해서
하나 이상의 dye로 착색됩니다.
오늘 게시글은 여기서 마치겠습니다 :)
다음 포스팅은 여러가지 Staining method에 대한 내용으로 올게요 😀😀😀
이상한 내용이 있다거나, 궁금하신게 있으시다면 언제든지 댓글 달아주시면 감사하겠습니다!

참고 사이트 및 문헌
1. COLOR ATLAS of VETERINARY HISTOLOGY third edition
'재미있는 생물학 > 재미있는 생물학' 카테고리의 다른 글
| 6. [ Antibody란? ] 1차 항체와 2차 항체 (1) | 2022.05.27 |
|---|---|
| 5. N2 purging (1) | 2022.05.27 |
| 4. Brain Staining Dye (0) | 2022.05.27 |
| 3. [ Brain Connectomics ] Basic Informations (2) | 2022.05.26 |
| 2. [ ELISA란? ] Enzyme-Linked ImmunoSorbent Assay (0) | 2022.05.26 |